
タンパク質、取っていますか?肉や魚から取れるタンパク質ですが、実は、そのままでは使えません。私たちはタンパク質を取り入れ、体内で一度分解してから、使える形に作りなおしているのです。
タンパク質合成で働く物質の一つが、RNA(リボ核酸)です。RNA内の立体構造の一つを、生きた細胞内で検出することに成功したのが、北村 朗(きたむら あきら)講師(先端生命科学研究院)です。2023年1月19日発表のプレスリリース「蛍光明滅を利用したRNA立体構造検出に成功」について、北村講師にインタビューしました。
―タンパク質を合成するとき、RNAはどのように働きますか?
タンパク質を合成するための情報は、細胞内のDNA(デオキシリボ核酸)という物質が持っています。まず、DNAの持つ情報がRNAに写し取られます。そのあと、RNAの情報を元にタンパク質が合成されるのです。
―RNAは、どのような構造をしているのですか?
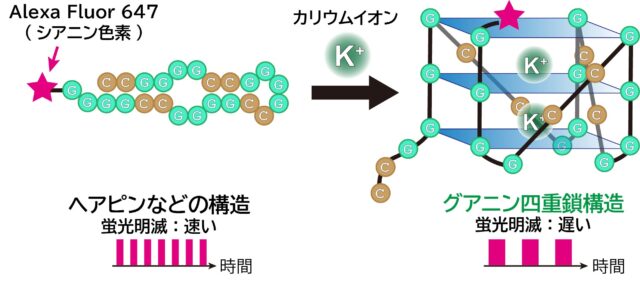
たくさんの原子がつながった、一本の長い鎖のような分子です。鎖の途中に立体的な構造ができることもあります。今回は「グアニン四重鎖構造」に注目しました。
―その構造があると、何が起きるのでしょう?
RNAの鎖の上には、タンパク質を合成するための情報が並んでいます。情報の読み取りは、RNAが伸びていないとできません。グアニン四重鎖構造があると、情報は読み取られず、タンパク質の合成は止まってしまいます。
―すると、グアニン四重鎖構造は、ない方がいいのですか?
そうとも限りません。グアニン四重鎖構造を作ったりほどいたりすることで、タンパク質の合成を制御しているとも考えられます。
ところで、細胞内のいつどこでグアニン四重鎖構造ができているのかどうか、知っている人は誰もいないのですよ。
―誰も知らない?なぜですか?
生きた細胞の中で今調べたいRNAのグアニン四重鎖構造を簡単に識別する方法が、これまでなかったからです。

―その識別方法を見つけたのですね。どのような方法ですか?
まず、RNAにシアニンという蛍光色素をつけました。蛍光とは、ある色の光を当てると、違う色の光が出てくる現象です。でも蛍光は、光を当てているとずっと光り続けているわけではありません。
―光り続けていないとは?
時間を区切って観測すると、光ったり消えたりを繰り返していると分かります。この明滅の時間間隔を測定しました。その結果、グアニン四重鎖構造が作られている場合は、明滅の速度が遅くなることを発見しました。
―明滅の速さから構造が分かるのですね。今後、どのような研究につながりますか?
生きた細胞内で、グアニン四重鎖構造が、いつ、どこで、どのくらいできているのか。リアルタイムに分かるようになるでしょう。本当にタンパク質の合成を制御しているのかも確かめられます。
また、ALS(筋萎縮性側索硬化症)という病気では、グアニン四重鎖構造が過剰にできると考えられています。実際に生きた細胞内で確認し、病気の原因を探りたいです。

―ところで、昔から生物に興味があったのですか?
いえ、生物よりも、分子そのものが好きでしたね。
―では、なぜ生物系に?
私が大学に進学したころは、「生命=未知の世界」というイメージがありました。自分が好きな分子を扱って、生命の謎を解明したい。そう考えて、学部では化学を勉強し、大学院では生物分野を選択しました。今は生物と化学の中間領域で研究しています。
―主な研究テーマは?
体内でのタンパク質合成は、失敗することも多いです。タンパク質の不良品が溜まると、ALSなどの病気につながります。そこで、不良品を直そうとする物質「シャペロン」に注目しています。
―タンパク質の不良品は、直せるのですね。
シャペロンの働きで、タンパク質の生産効率が上がれば、病気を治したり、病気の進行を遅らせたりできます。
―シャペロンは大事な存在ですね。
工業生産に例えると、裏方の職人さんと言えます。大事だけど、地味な存在。そこに光を当てたいですね。
―今後の目標は?
今のところ、シャペロンは全てタンパク質です。しかし、私はタンパク質以外の物質、例えばRNAなども、シャペロンの機能を持つと考えています。この仮説を立証していきたいです。
北村講師が光を当てることで、裏方のシャペロンが輝く日も近いのではないでしょうか。

北海道大学プレスリリース
蛍光明滅を利用したRNA立体構造検出に成功~生細胞内におけるRNAグアニン四重鎖構造の新規検出法を確立~(先端生命科学研究院 講師 北村 朗)
https://www.hokudai.ac.jp/news/pdf/230119_pr.pdf