
生物の細胞は、生きていくために物質を取り入れたり出したりしています。物質が出入りするときには、タンパク質が働きます。物質を運ぶタンパク質について調べているのが、先端生命科学研究院の塚本 卓(つかもと たかし)助教です。
2023年10月10日に出されたプレスリリース「タンパク質ドメインの見過ごされてきた機能的役割を解明~イオンチャネルの新しいイオン選択の仕組みの解明に向けて~」について塚本助教に話を聞きました。インタビューには論文の筆頭著者である、生命科学院 修士2年の大木 優也(おおき ゆうや)さんにも参加してもらいました。
初めにプレスリリースの内容について塚本助教に聞きました。
イオンチャネルって何ですか?
生物の細胞は膜で覆われています。細胞膜の内側と外側では物質がやりとりされますが、物質の多くは細胞膜をそのまま通り抜けることができません。物質は細胞膜に埋め込まれた「膜輸送タンパク質」を通って出入りします。膜輸送タンパク質の一つがイオンチャネルです。
今回は、どのようなイオンチャネルを研究したのですか?
アニオン(マイナス電荷を持つ陰イオン)を通すアニオンチャネルロドプシン(ACR)を研究しました。対象にしたのは、海に生息する藻類ギラルディア・シータ(Guillardia theta)が持つアニオンチャネルロドプシン、GtACR1です。
GtACR1は藻から取るのですか?
いえ、実験で使うGtACR1は、微生物の一種である酵母に作らせています。
GtACR1は、どのようなものですか?
GtACR1は細胞膜に埋まって働きますが、細胞の内側に「細胞内ドメイン」とよばれる部分がひょろっと伸びています。細胞膜に埋まっている「ロドプシンドメイン」だけでもイオンチャネルとして機能するため、従来は細胞内ドメインを切除したGtACR1が作られ研究されてきました。
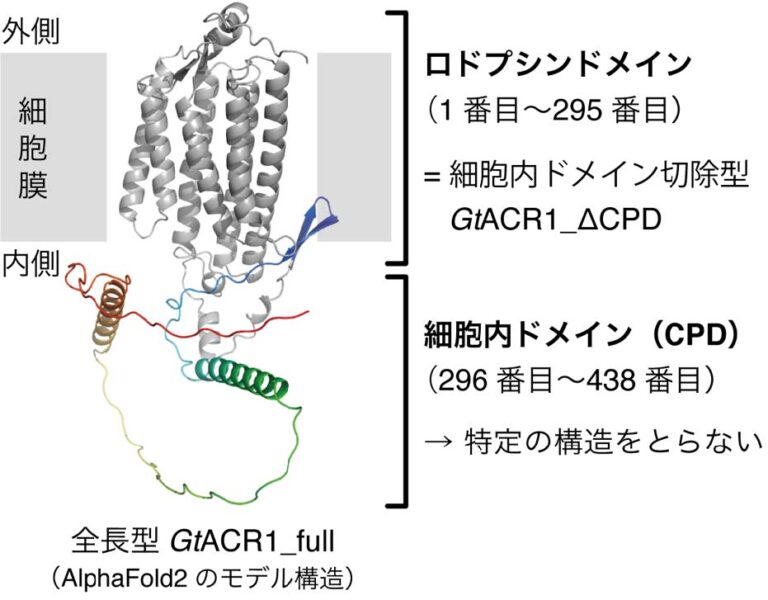
GtACR1を作るとき、細胞内ドメインを切った方がいい理由はありますか?
短いタンパク質の方が、多く作ってもらえる利点があります。でも私たちは、切除されている部分にも何かしらの働きがあるのではないかと考え、細胞内ドメインがついたままのGtACR1を作って調べてみました。
長いままのGtACR1を作るのは、難しくなかったのですか?
実は、最初は作れるなんて思っていませんでした。ダメ元で試してみたら成功したのです。
短いものとの違いは何かありましたか?
細胞内ドメインがついた全長型のGtACR1は、硝酸イオン(NO3-)を通しやすくなります。
硝酸イオンを通しやすいのはなぜですか?
硝酸イオンが存在すると、GtACR1がイオンを通す状態を長く保つことが分かりました。ただ理由はまだ分かりません。

続いて、実験を進めた大学院生の大木さんにも話を聞きました。
今回の研究のポイントは?
アニオンチャネルロドプシンの「全長型」に注目したことです。全長型を作ったのは私たちが初めてです。全長型には、イオンを選択して通す働きがあると分かりました。細胞膜を通るイオンを選択する仕組みとして、新たなものを発見したと言えます。
苦労したことは、ありましたか?
GtACR1のサンプルを作るのに苦労しました。全長型は、切除型に比べると4分の1しか酵母が作ってくれません。さらに、酵母からタンパク質を取り出すときも効率が悪いのです。酵母の培養液を10倍くらい準備しないと、必要な量のサンプルが取れません。
GtACR1は赤く見えるので、取れた量が色の濃さで分かります。少ないときは、目で見て分かるからこそ余計に悲しい気持ちになりました。

今後は、どのように研究を進めていきたいですか?
GtACR1を持つギラルディア・シータは海の生物なので、海水に近い環境で何が起きるかを知りたいです。塩化物イオン(Cl-)と硝酸イオンの両方があったら、GtACR1はどちらを運ぶのか、どれくらいの差が出るのか。確かめる実験を続けています。
* * *
大木さんは塚本助教の指導の下で実験を進め、論文を書き上げました。成果が出たのは運も良かったと話す二人。今だから笑えるものの、なかなか厳しい戦いだったそうです。








