私たちが運動できるのも、ものを見られるのも、体の中でタンパク質が働いているおかげです。目に見えないタンパク質の働きは、どうしたら分かるのでしょうか?
「タンパク質の働くしくみを知りたい!」と研究を続けているのが、菊川 峰志(きくかわ たかし)准教授(先端生命科学研究院)です。2023年10月に発表された論文「光駆動ナトリウム ポンプ ロドプシンのゲート開口につながる多段階の構造変化」について、菊川准教授にインタビューしました。

ナトリウム ポンプ ロドプシンとは、どのようなものですか?
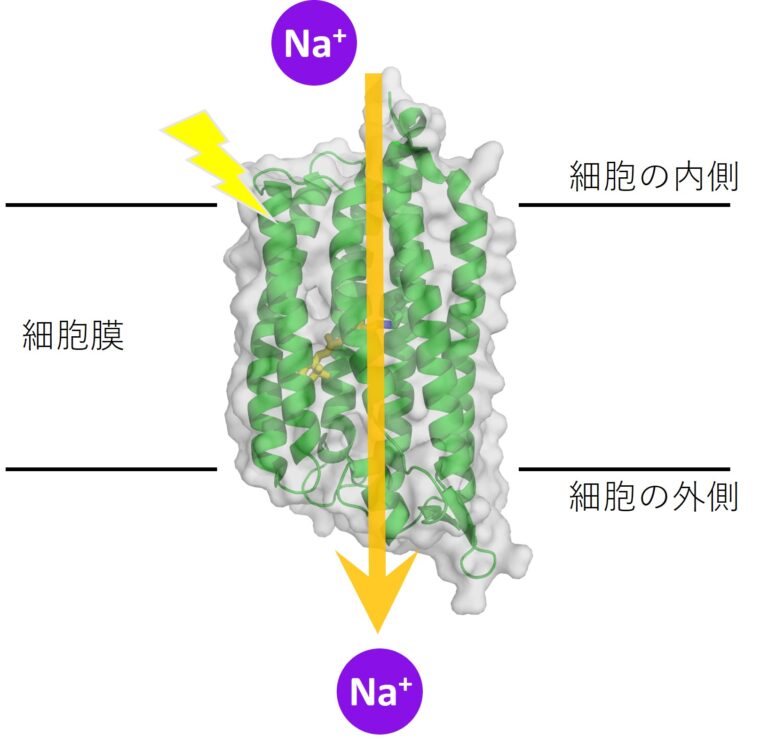
ロドプシンはタンパク質の一種で、生物の細胞を包む膜に埋まっています。光を使って仕事をするのが特徴です。
ロドプシンは光を受けると段階的に構造が変化します。構造が変わって安定な状態になり、また少し構造が変わって次の状態になり、最終的には元の形に戻ります。構造変化の途中で、ナトリウムイオンを細胞の内側から取り込み、外側へ放出するのがナトリウム ポンプ ロドプシンです。細胞の中から外へ物質を汲み出すポンプのように働きます。
ナトリウムイオンを汲み出すのは、どうしてなのでしょうか?
栄養物を取り込むタンパク質を動かすためだと考えられています。外側のナトリウムイオン濃度が高くなると、ナトリウムイオンは内側へ戻ろうとする傾向が強くなります。栄養物を取り込むタンパク質は、この傾向を利用して、ナトリウムイオンを内側へ運びながら、同時に、栄養物も運ぶことができます。
この研究を始めたきっかけは?
同じ研究院に、タンパク質を結晶化して構造を調べている研究室があります。その研究室から「ロドプシンの構造を調べてみたい」という話を持ちかけられました。当時、ナトリウム ポンプ ロドプシンの構造は知られていなかったので、成功すれば大きな成果になると思い、一緒に研究を始めました。
ところが、途中で他の研究グループに先を越されてしまいました。世界的に権威のある雑誌「ネイチャー」で、別のナトリウム ポンプ ロドプシンの構造が発表されたのです。
なんと…。
落胆しました…。しかし、私たちのロドプシンも結晶化はできていて構造が解けそうだったので、研究は続けることにしました。
何が分かりましたか?
結晶化したロドプシンは、上向き、下向き、上向き…と互い違いに並んでいました。片方の向きのロドプシン(分子A)の構造は、先に発表されたものと似ていましたが、反対向き(分子B)の構造は少し違っていたのです。
構造の違うところとは?
タンパク質は多くのアミノ酸がつながった分子です。分子Aでは108番目につながったアルギニンというアミノ酸が、ナトリウムイオンの経路をふさぐように上を向いています。ところが分子Bだと、このアルギニンは下を向いており、経路が開かれているようです。
もしかして分子Bは、ナトリウムイオンを放出するときの構造なのではないか?そこで、ロドプシンの中で起きていることのモデルを考えました。
どのようなモデルですか?
ロドプシンが光を受けて形を変えると、アルギニンの近くにあるアミノ酸同士のつながりが切れます。すると辺り一帯のアミノ酸の配置が変わり、空いた場所でアルギニンが下を向く「首振り」が起こると考えられます。
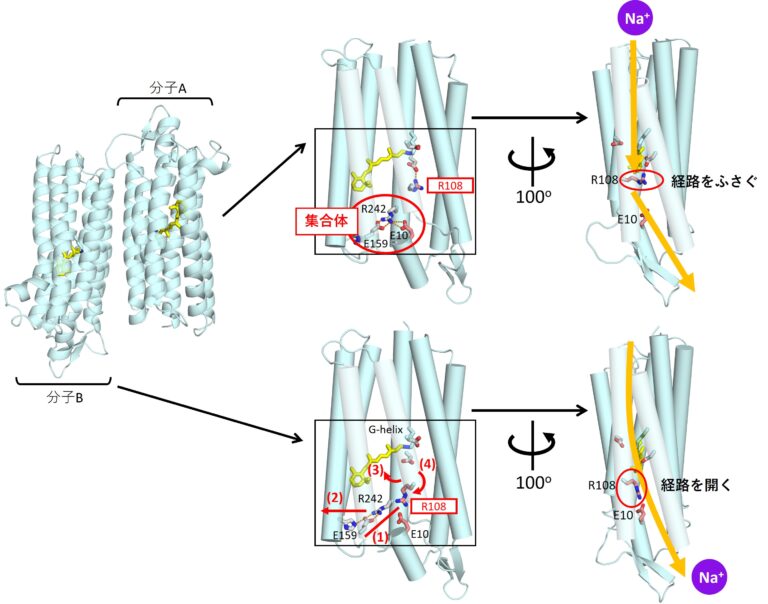
(右上)分子Aではアルギニン108(R108)がナトリウムイオンの経路をふさぐように上を向いている。(右下)一方、分子BだとR108は下を向いて経路を開いている。
(中央上)分子Aでは、R108の近くで、3つのアミノ酸:E10(10番目のグルタミン酸)、E159(159番目のグルタミン酸)、R242(242番目のアルギニン)が集合体を作っている。
(中央下)アルギニンの首振りモデル。(1)E10と他のアミノ酸の結合が切れると、(2)E159とR242が左側へ動き、(3)R242のつながるGヘリックス(G-helix)と呼ばれる棒状の構造が、紙面向こう側へ少し回転し、(4)辺り一帯のアミノ酸同士の結合が切れて配置が変わり、R108が下を向く。
アミノ酸の細かい動きを確かめる方法は、あるのですか?
どのアミノ酸が働くと首振りが起こるのか?アミノ酸を入れ替えたり、それぞれが持つ電荷を変えたりして調べました。実験の結果、モデルが正しそうだという結論に達しました。
今回の研究のポイントは?
タンパク質が働くとき、どういう順番で何が起きているのか?明らかにしたいという思いは、ずっと持ってきました。ここまで細かく順を追ってアミノ酸の動きが分かったのは初めてです。
タンパク質は生体内でさまざまな働きをしています。タンパク質の機能が現れるためには構造変化が重要なはずです。変化の一端を明らかにしたところに意義があると思っています。







